缺血性脑卒中最有效的治疗方法是恢复梗死区 血流灌注,但由此引发的再灌注损伤问题也凸显出 来。脑缺血再灌注损伤是一个十分复杂的过程,神 经元凋亡在其损伤过程中起着重要作用,是损伤所致 一系列有害生化级联反应的结果。
1 材料与方法
1.1 实验动物与分组
60 只体质量 220~240 g 的 SPF 级 3 月龄雄性 SD 大鼠(三峡大学实验动物中心,许可证号: SCXK(鄂)2012-0068),按照随机数字表分为假手 术组、缺血/再灌注组和电针预处理组,每组 20 只。饲 养于湖北中医药大学实验动物中心,室温 20~25 ℃, 光照时间(7:00-19:00)。本实验过程中对动物的 处置严格按照科技部398 号《关于善待实验 动物的指导性意见》文件要求进行。
1.2 主要试剂与仪器
主要试剂:p53 抗体、caspase-3 抗体(批号分 别为 sc-71820、sc-271759,Santa 公司);TUNEL 试剂盒(批号为 11684817910,Roche 公司);TTC 染色液(批号为 A610558-0025,Sangon Biotech 公 司);DAB 显色剂(K5007,DAKO 公司)。 主要仪器:3400 线栓(广州佳灵);RM2016病理切片机 (上海徕卡仪器有限公司 ) ; Nikon Eclipse Ti-SR 倒置荧光显微镜、Nikon DS-U3 成像系 统(日本尼康);HANS-200 电针治疗仪(北京华运 安特科技有限责任公司);华佗牌毫针(0.25 mm× 13 mm,苏州医疗用品厂)。
1.3 模型制备
缺血/再灌注组和电针预处理组,参照 Longa 等造模方法,建立大鼠右侧局灶性脑缺血再灌注损伤模 型。大鼠禁食 12 h,仰卧位固定,2%戊巴比妥钠溶液 (3 mL/kg)腹腔注射麻醉,消毒后沿颈部正中剪一 切口,长约 2 cm,向右纵行逐层钝性分离肌肉及筋膜, 在颈前肌群近前斜角肌端处游离右侧颈总动脉(CCA) 及其分支颈内动脉(ICA)和颈外动脉(ECA),术中 注意保护迷走神经。
1.4 干预方法
电针预处理组造模前先进行电针干预,参照华 兴邦等制定的《大鼠穴位图谱的研制》取穴,“百 会”位于大鼠顶骨正中,“肾俞”位于第 2 腰椎下两 旁,“三阴交”位于后肢内踝尖直上 10 mm,其中 “百会”经皮沿脑正中线向额斜刺约 2 mm,“肾 俞”直刺约 6 mm,“三阴交”直刺 4~5 mm。同侧“肾 俞”和“三阴交”接成一对电极,“百会”与其旁 开 1 cm 处提捏皮肤浅刺 1 mm 的辅助电极接成一对 电极,接 HANS-200 电针治疗仪,予疏密波,频率 2 Hz/100 Hz,强度 1 mA,通电 10 min,留针不通电 5 min,连续重复 4 次,共计 1 h。电针干预结束后 观察 30 min 行造模手术。此过 程中应防止缓冲液过度蒸发,切勿干片。自然冷却后 将玻片置于 PBS(pH=7.4)中在脱色摇床上晃动洗涤3 次,每次 5 min。3% H2O2溶液阻断内源性过氧化物 酶,加兔抗 p53 抗体、兔抗 caspase-3 抗体(1∶ 200)孵育过夜,滴加二抗,DAB 显色,显微镜下 控制显色时间,阳性为棕黄色,流水冲洗切片终止 显色,脱水封片。每组 10 个样本,每个样本切片在 海马 CA3 区随机挑选 3 个 200 倍视野进行拍照,应 用 Image-Pro Plus 6.0 软件对每张照片进行分析得出 阳性区域的累积吸光度,取其均数为该样本的 IOD 值,IOD 值越大,阳性表达越强。
2 结果
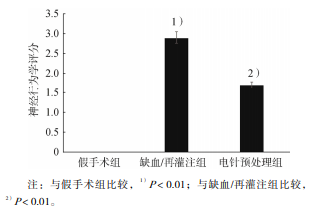
假手术组无神经功能丧失;缺血/再灌注组神经 行为学改变明显,大鼠左前肢明显不能充分伸展, 或向左环行运动,出现轻度局灶神经功能丧失,或 向左侧倒,出现中度局灶神经功能丧失;电针预处 理组神经行为学症状较缺血/再灌注组明显减轻。 缺血/再灌注组神经行为学评分明显高于假手术组 (P<0.01);缺血/再灌注组和电针预处理组神经 行为学评分分别为 2.95±0.22 和 1.75±0.64,电针 预处理组明显低于缺血/再灌注组(P<0.01)。见 图 1。
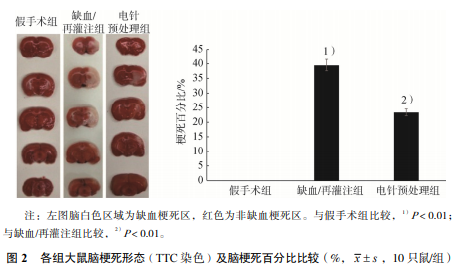
假手术组大鼠右侧未见脑梗死灶,缺血/再灌注 组大鼠右侧脑梗死灶明显,两组间脑梗死百分比比 较,差异有统计学意义(P<0.01);与缺血/再灌注 组比较,电针预处理组大鼠右侧梗死面积明显减小 (P<0.01)。见图 2。缺血/再灌注组右侧海马 CA3 区 p53 阳性表达明显增多(P<0.01);与缺血/ 再灌注组比较,电针预处理组右侧海马 CA3 区 p53 阳性表达量明显减少(P<0.01)。caspase-3 为细胞 质着色,阳性细胞呈棕黄色,其中假手术组大鼠右侧 海马 CA3 区仅有极少量神经元胞质黄染,缺血/再灌 注组右侧海马 CA3 区大量神经元胞质黄染,caspase-3 的阳性表达明显增多(P<0.01);与缺血/再灌注组 比较,电针预处理组右侧海马 CA3 区 caspase-3 的 阳性表达明显减少(P<0.01)。
3 讨论
脑缺血再灌注损伤的发生机制十分复杂,包括 炎性反应、氧化应激、细胞凋亡、兴奋性毒性等, 这些因素彼此关联,相互重叠,最终导致缺血区细 胞损伤、凋亡甚至坏死,进而引起脑功能障碍 。 研究表明,神经元凋亡是脑缺血再灌注损伤所致 一系列有害生化级联反应(这些反应包括钙稳态失 衡所致兴奋性中毒,内质网及线粒体功能受损,自 由基氧化应激引发 DNA 损害,促凋亡基因表达的上 调,效应半胱氨酸蛋白酶的激活,核酸内切酶降解 基因组等)的结果,是脑缺血再灌注损伤的重要发 生机制之一。
免责声明:文章仅供学习和交流,如涉及作品版权问题需要我方删除,请联系我们,我们会在第一时间进行处理。